Quelques commentaires suite à la correction des sujets
- Lorsque vous interprétez un bilan biologique, n’oubliez pas de toujours préciser l’unité.
Des valeurs de référence sans unité n’ont pas de sens et c’est pourquoi les points n’ont pas été accordés dans ce cas.
- Dans les exercices, faites bien attention aux unités qui vous sont demandées. Celles-ci sont soit précisées dans la question, soit indiquées au sein de l’énoncé d’introduction.
- Enfin, dans l’exercice n°2, le terme « alpha » manquait au lexique et j’ai donc pris en compte à la place le terme « alpha 4 ».
Cas clinique « méningite chez un jeune homme de 25 ans » : focus sur le traitement d’un LCR au laboratoire
Pour ce premier débrief, revenons sur la prise en charge d’un LCR au laboratoire d’un point de vue pratique. Il est toujours plus facile de mémoriser les choses quand on les comprend concrètement !
Le diagnostic de méningite est une urgence. Ainsi, tout LCR reçu au laboratoire doit pouvoir être traité sans délai 7j/7 et 24h/24.
Il est classiquement indiqué dans les livres de recueillir le LCR dans 3 flacons stériles. En fait, cette préconisation est surtout liée à l’organisation interne des laboratoires en plusieurs services distincts : de cette façon un flacon part dans le service de microbiologie, un autre dans le service d’hématologie et le 3ème dans le service de biochimie. On gagne ainsi du temps puisque toutes les analyses peuvent être réalisées simultanément.
Quelles sont les différentes étapes suite à l’arrivée d’un LCR au laboratoire ?
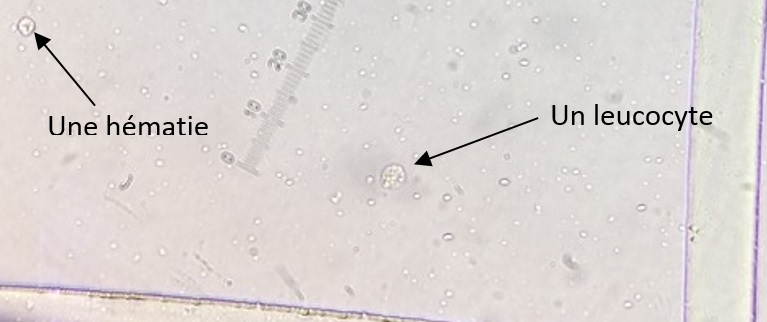
1) Numération des leucocytes et hématies par mm3
Pour cela, on utilise une cellule de Kova ou une cellule de Malassez dont le principe est équivalent.
Voilà une lame de Kova, composée de 10 cellules de comptage :

1 mm3 de LCR est introduit dans la cellule de comptage puis on l’observe au microscope.
Une cellule est composée d’une grille de 81 petits carrés :
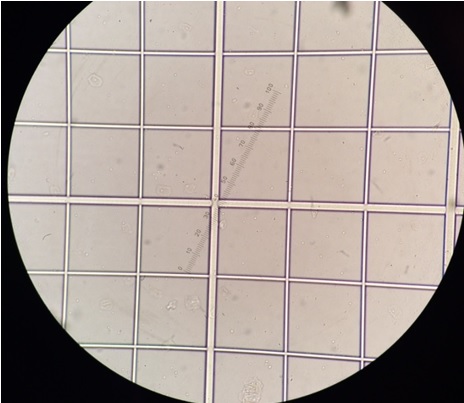
En passant au grossissement x40 on peut ainsi observer et compter le nombre de leucocytes et d’hématies contenus dans l’ensemble de la cellule de comptage, soit dans 1 mm3.
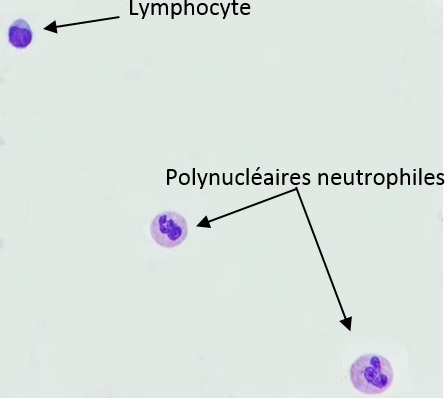
2) Formule leucocytaire
Si des leucocytes sont présents, une formule doit être réalisée pour apprécier la prédominance de la lignée granuleuse ou de la lignée lymphocytaire et orienter ainsi le médecin vers une origine bactérienne ou virale. Pour cela, quelques gouttes de LCR sont déposées sur une lame puis une coloration au MGG est réalisée. Il reste ensuite à compter 100 cellules pour obtenir la formule. Voilà ce que vous pourrez observer :
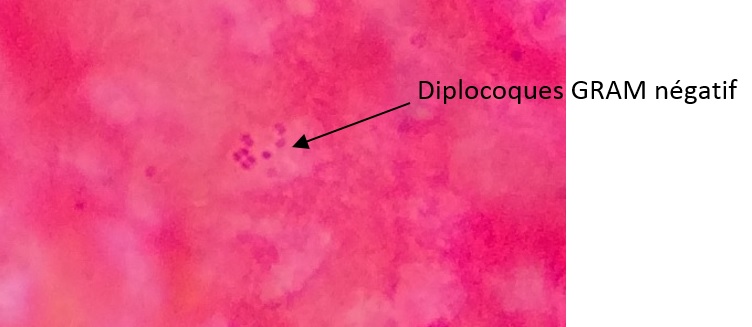
3) Examen direct avec réalisation d’un GRAM
Systématiquement, un GRAM doit être réalisé sur un frottis du LCR. Voici ce qui a pu être observé dans le cas clinique de ce mois-ci (le fond rose est un artefact de coloration) :
Toutes ces étapes doivent permettent de rendre un premier résultat rapidement, dans l’heure. Bien sûr, une mise en culture est indispensable pour identification du germe en cause et réalisation d’un antibiogramme.
Pour information, une nouvelle technique se développe aujourd’hui et permet une petite révolution dans la prise en charge de ce type de prélèvement. Il s’agit de la PCR multiplex qui permet d’identifier directement dans le LCR, en 1h seulement (versus au mois 24h pour la culture), la présence éventuelle d’une bactérie, d’un virus ou d’une levure parmi un ensemble de 14 germes prédéfinis (les plus fréquemment impliqués). Cette technique entièrement automatisée réalise tour à tour une extraction de l’ADN présent dans l’échantillon, une PCR qui amplifie spécifiquement les 14 cibles du panel et enfin une détection de la cible éventuellement amplifiée.
A l’heure actuelle, la technique commercialisée permet la détection de : E.coli K1, H.influenzae, L.monocytogenes, N.meningitidis, Streptocoque B, Str.pneumoniae, CMV, Entérovirus, HSV-1, HSV-2, HHV6, VZV, Parechovirus et enfin Cryptococcus neoformans.
Si cette technique permet d’obtenir le nom du germe dans l’heure qui suit la ponction de LCR, elle ne se substitue pas à la culture qui elle seule permettra d’obtenir un antibiogramme.